![]()
PUREfrex® 酶无细胞蛋白合成试剂盒
PUREfrex® 是一款单独纯化蛋白合成所需的因子后,与氨基酸和NTP等混合重组的蛋白合成试剂盒。通过减少试剂盒中的大肠杆菌来源脂多糖,合成的蛋白无需纯化即可直接用于细胞实验和检测。对于首次想要尝试本产品的用户,本产品还可提供小包装规格。

从减少塑料使用的环保观点出发,并为了满足需要更多反应液的客户需求,PUREfrex® 试剂盒系列已停止生产5×250 µL反应用(1.25 mL反应用)规格的产品,并全新推出了“2 mL反应用”规格的产品。
新规格与旧规格产品相比,反应液的性价比更高。
◆关于PUREfrex®
PUREfrex® 是基于PURE system开发的重组无细胞蛋白合成试剂盒。PURE system是东京大学的上田卓业教授团队开发的重组无细胞蛋白合成系统,是将转录、翻译和能量回收所需的蛋白和核糖体单独纯化,然后与氨基酸、NTP等混合的合成系统。通过添加编码目标蛋白的DNA或mRNA至反应液中进行反应来合成蛋白。由于使用了组分经纯化的混合反应液,因此具有可自由调整其组成,且几乎不含与翻译等无关的蛋白的优点。
PUREfrex® 改良了反应液中蛋白、核糖体和tRNA的制备方法,是一款与传统产品相比,纯度更高的合成反应溶液。此外,大肠杆菌来源的污染性脂多糖含量降低至每µL反应液10-1 EU以下,并且 RNase和β-半乳糖苷酶等污染蛋白也有减少。此外,PUREfrex® 的所有蛋白(包括翻译因子等)中均不含纯化和检测用的标签。因此可合成添加了任何标签序列的蛋白,后续可利用该标签进行纯化和检测。
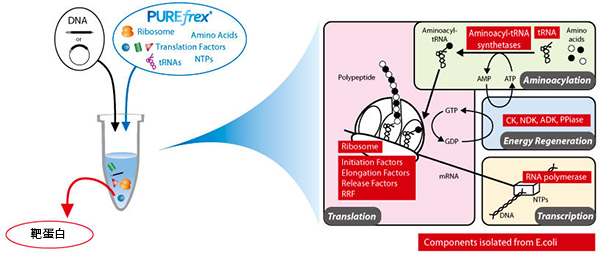
使用PURE系统进行蛋白合成的原理图
◆特点
● 由经纯化组分组成的反应液,非细胞提取液。
● 可以利用多种模板进行反应,还能合成Fab等多聚体。(多种模板混合下的Fab合成示例见下文)
● 可合成活细胞难以合成的强毒性蛋白。(蛋白毒性合成示例见下文)
● 模板DNA可直接添加至PCR反应液使用。
● 反应液量内合成的蛋白量几乎恒定(数 µL~数 10 mL)。
● 操作简便,仅需在单试管中37℃孵育数小时。
● 可合成带标签的蛋白,用于下游纯化和检测。
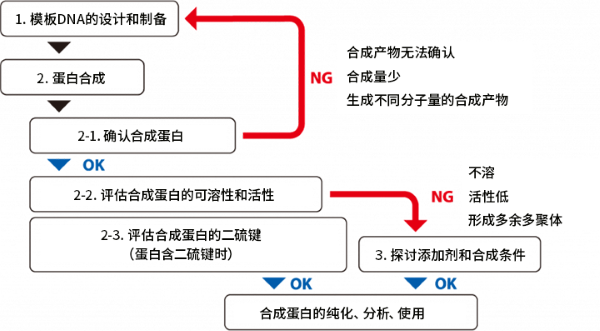
◆使用PUREfrex® 进行蛋白合成的实验流程
◆PUREfrex® 使用方法
实验方案示例
使用PUREfrex®1.0时,可使用任意体积的反应液进行蛋白合成。例如,20 μL时反应液的制备方法如下所示。
1. 将SolutionⅠ在室温~37℃下加热1 min左右至完全融解,随后置于冰上。
2. 将Solution Ⅱ和Solution Ⅲ置于冰上融解。
3. 将融解的SolutionⅠ,Ⅱ,Ⅲ轻轻涡旋后,离心并收集试管底部的内容物。
4. 根据下述列表制备反应液。(DNA添加量为每kbp 0.5-3 ng/ μL)
|
Water |
8-X µL |
|
Solution Ⅰ |
10 µL |
|
Solution Ⅱ |
1 µL |
|
Solution Ⅲ |
1 µL |
|
模板DNA 注1 |
X µL |
|
Total |
20 µL |
5. 在37°C的加热块或水浴中反应 2~4 h,合成蛋白。注2
6. 合成的蛋白可用于多种用途。注3
注意事项
注1)模板DNA请根据目标蛋白自行制备。
注2)如果在气相恒温器(如培养恒温器)中进行反应,反应溶液的温度上升需要花费更多的时间,合成量会有所降低。
注3)通过SDS-PAGE确认合成时,请用水稀释反应液后进行电泳。详情请点击此处查看。
注4)反复冻融会导致活性降低,因此,实验系统用量较少时,建议少量分装。少量分装后,请将Solution Ⅱ和Solution Ⅲ用液氮或干冰/乙醇快速冷冻,并在-20°C 或 -80°C 下储存。若不快速冷冻,而是直接放入注4-80℃缓慢冷冻,会导致核糖体(Solution Ⅲ)等因子失去活性。此外,为避免核酸酶污染,建议佩戴手套和口罩。
◆模板DNA设计
蛋白合成时,向本试剂盒Solution Ⅰ,Ⅱ,Ⅲ 的混合反应液中添加模板DNA,同时进行转录和翻译反应。注意,制备适合PUREfrex®合成的模板DNA是蛋白合成的关键之一。详细的制备方法请参阅模板DNA网页。
使用PUREfrex®设计适合蛋白合成的模板DNA时的要点
● 对于ORF整体:
基于大肠杆菌密码子的使用频率使用密码子
将导致移码的序列(如 X/XXY/YYYZ)替换为其他的密码子
● 对于N端:
使用富含AT碱基的密码子
开始使用蛋氨酸后,应立即尽可能避免使用脯氨酸和甘氨酸。
● 对于5’UTR区:
含SD序列(核糖体结合序列)
SD 序列上游含15 个或以上的富含AT碱基的序列
PUREfrex®2.0 mini—适合首次使用的用户
进行蛋白表达时,需要考虑宿主、表达载体、诱导、不溶性等多种因素。首次使用PUREfrex®或首次尝试无细胞系统的用户可能会产生是否真的可以合成蛋白,或者即使成功合成,蛋白合成量是否太少的疑问。
对于PUREfrex® ,因为任何生物来源蛋白的模板DNA组成均相同,所以无需考虑宿主或载体等因素。PUREfrex®2.0mini附带通用引物和详细说明,因此,适合初次使用的用户尝试合成所需的蛋白。
|
组成成分 |
客户自备 |
|
PUREfrex®2.0(蛋白合成试剂) |
目标蛋白基因 |
|
T7PRO-SD primer (包含5' UTR 序列的引物) |
Fw 和 Rev 的引物 (使用PCR产物作为模板DNA 时) |
|
DHRF DNA(阳性对照用模板 DNA) |
◆蛋白合成反应液和添加剂的选择
请根据用途选择蛋白合成反应液和添加剂。
蛋白合成反应液
● PUREfrex® 1.0
PUREfrex® 1.0已公开反应液组成,适用于产品定制等需要组成成分信息的研究。此外,虽然使用 PUREfrex® 2.0合成蛋白时的速度较快,但可能无法及时形成和折叠二硫键等导致不溶时,此时使用合成速度较慢的PUREfrex® 1.0效果可能更好。
反应液组成点击此处查看
● PUREfrex® 2.0
PUREfrex® 2.0改良了PUREfrex® 1.0的反应液组成,提高了蛋白合成效率,从而增加了反应液内的蛋白合成量。适用于需要合成大量蛋白及多种蛋白的研究。反应液组成保密。
● PUREfrex® 2.1
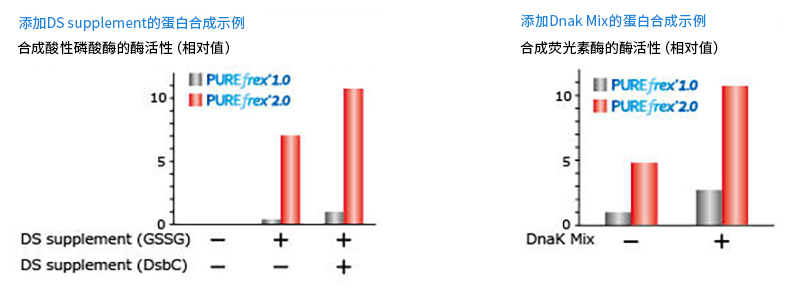
PUREfrex® 2.1适用于需严格控制氧化还原状态的含二硫键结合的蛋白合成。它在保留PUREfrex® 2.0 反应液组成的基础上,单独添加了还原剂,因此可根据添加的还原剂(和氧化剂)种类和数量来调整合成过程中的氧化还原状态。并且,还可用于探讨适用于细胞中难以表达的含二硫键结合的蛋白合成条件。此外,作为添加剂的DsbC Set(原:DS supplement)和DnaK Mix也能加入反应液中使用。
● AppA合成示例和IgG合成示例
蛋白合成用添加剂
● DnaK Mix
DnaK Mix是经高度纯化的大肠杆菌来源的DnaK、DnaJ、GrpE蛋白以适当的浓度比例预混后的溶液。
● GroE Mix
GroE Mix是经高度纯化的大肠杆菌来源的GroEL、GroES蛋白以适当的浓度比例预混后的溶液。
此类分子伴侣混合物可有助活性蛋白的合成,而仅使用单个分子伴侣往往难以形成高阶结构。
目前还未明确哪种添加剂效果好,实际效果取决于需合成的蛋白。但如果是首次尝试,推荐使用合成效果更广泛的DnaK Mix。
● DsbC Set (原:DS supplement)
含有作为氧化谷胱甘肽(GSSG)和二硫键异构酶的大肠杆菌 DsbC。
● PDI Set
含有氧化谷胱甘肽(GSSG)、人源二硫键异构酶(PDI)和PDI的氧化酶Ero1α。
可为形成二硫键创造优质环境。二硫键的形成可能只需要氧化剂GSSG,也可能需要具有二硫键异构化活性的DsbC或PDI。氧化剂GSSG和Ero1α一样也会氧化PDI,但它还可以氧化反应液整体。另一方面,Ero1α 是一种特异性氧化PDI的酶,如果无需氧化整个反应溶液时,建议使用Ero1α(PDI 组)。
● EF-P
大肠杆菌的翻译因子之一,在合成含有连续脯氨酸残基的蛋白时添加,可以增加合成量。
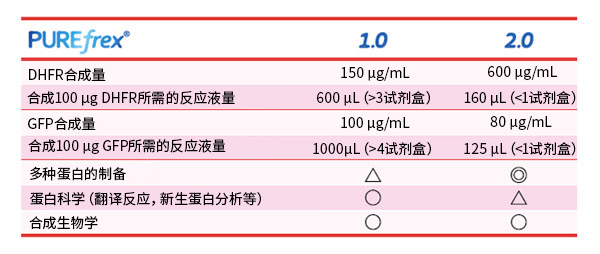
◆产品数据
PUREfrex®1.0和2.0的合成量对比
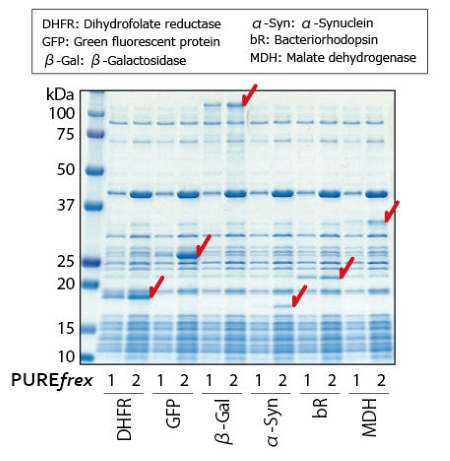
合成原核生物和真核生物来源蛋白的结果显示,与PUREfrex®1.0相比,使用PUREfrex® 2.0合成时各种蛋白的合成量增加。
添加剂效果对比
|
|
||
|
合成需要二硫键(SS键)的大肠杆菌酸性磷酸酶(AppA1)时,在PUREfrex® 2.0的基础上,添加了DS supplement。结果显示,在氧化剂和二硫键异构酶存在的情况下,活性蛋白合成量增加。 |
对于需要分子伴侣才能形成正确高阶结构的蛋白,使用PUREfrex® 2.0合成时,在分子伴侣存在的情况下,可确认活性蛋白合成量增加。 |
|
使用单试管合成多个不同的模板DNA
在多模板混合条件下添加 DsbC Set(原 DS supplement)合成 Fab 的示例
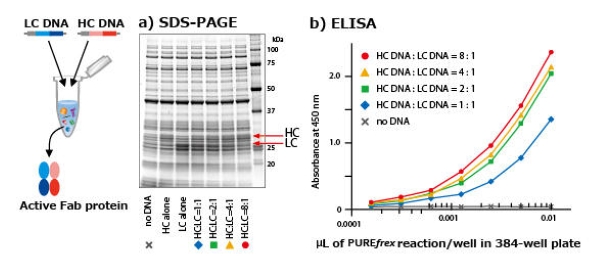
在PUREfrex® 2.0 的基础上添加DS supplement合成的结果显示,成功合成了由轻链(LC)和重链(HC)通过分子间二硫键相连而成de 活性Fab,且该活性Fab可以和抗原结合。另外,通过优化轻链(LC)和重链(HC)的模板DNA的添加比例,结果显示活性Fab的产量增加。(最高产量为0.5 mg/mL)
合成强毒性蛋白
蛋白毒素(Gelonin)的合成示例
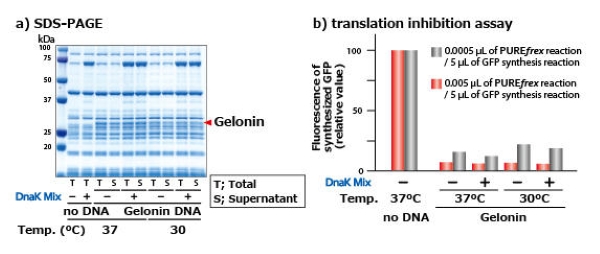
a)使用PUREfrex®2.0合成Gelonium multiflorum植物种子来源的蛋白毒素的实验中,结果显示成功合成了具有蛋白翻译抑制活性的毒素。
b)在HeLa 细胞来源的无细胞表达系统中合成 GFP时, 通过比较添加合成了Gelonin蛋白的PUREfrex® 反应液(未纯化)时的GFP活性,来确认翻译抑制的活性。(最高产量为0.5 mg/mL)
* Gelonin的分子量为30 kDa,通过灭活真核细胞的核糖体来抑制翻译。
起始密码子后的氨基酸密码子对合成量的影响
曲妥珠单抗重链(VH+CH1)的合成示例(替换起始密码子后的密码子)
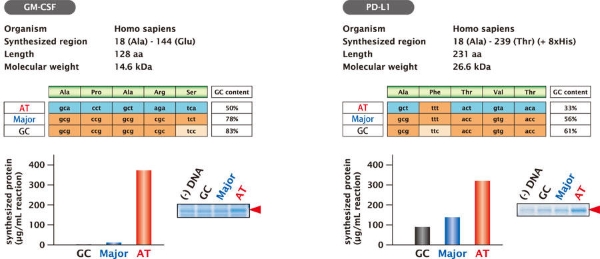
使用PUREfrex® 2.0,通过用了起始密码子后的第2~6个氨基酸处不同密码子的56种模板 DNA 合成Trastuzumab 的重链(VH+CH1)。结果显示,最高合成量和最低合成量间相差约50倍。合成量最高的模板 DNA 是使用低GC含量密码子的模板 DNA(AT),合成量随着 GC含量的增加而减少。此外,与大肠杆菌中使用频率高的密码子相比,通过使用了频率低但GC含量少的密码子的模板 DNA 进行合成时,合成率更高。
通过 PUREfrex® 2.1合成含二硫键结构的蛋白
1. 酸性磷酸酶(AppA)活性测试
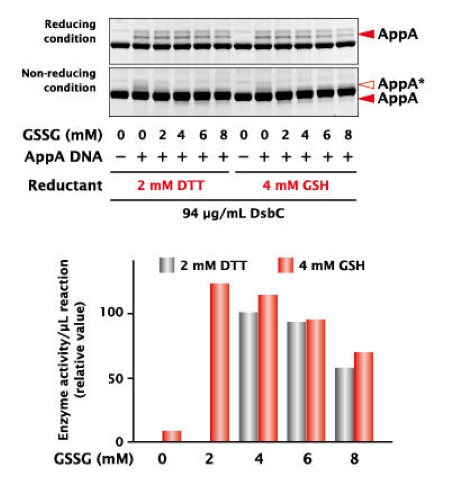
使用DTT和GSH(还原型谷胱甘肽)两种还原剂与改变浓度的GSSG(氧化型谷胱甘肽)和大肠杆菌的二硫化物异构酶DsbC合成需要二硫键(SS键)的 AppA*1,并比较其合成量和活性,结果显示,虽然从还原凝胶的电泳分析中没有发现合成量的显著差异,但活性根据使用的还原剂类型和浓度各异。
(*1 AppA有5个二硫键,其中一个为不连续的半胱氨酸残基间的二硫键。)
2. IgG的合成

通过添加 GSSG(氧化型谷胱甘肽)、大肠杆菌的二硫键异构酶 DsbC 和分子伴侣,并使用不同种类的还原剂,合成通过二硫键(SS 键)形成的两条L链(轻链)和两条H链(重链)的四聚体结构IgG。比较其合成量和活性的结果显示,虽然从还原凝胶的电泳分析中没有发现合成量的显著差异,但活性根据使用得还原剂类型和浓度各异。
更多其他的无细胞蛋白合成示例的数据详情点击此处查看。
大量论文引用,详情点击此处查看。
◆关于蛋白合成
Q1:是否可以合成人源蛋白等大肠杆菌以外的蛋白?
PUREfrex® 是大肠杆菌来源的重组翻译系统的蛋白合成系统,但也能合成哺乳动物和植物等高等真核生物来源的蛋白。点击此处查看合成各种蛋白的实例。
然而, 根据GC含量和次要密码子的出现频率等核酸序列,可能会降低蛋白合成的效率。
比起蛋白来源,模板DNA的碱基序列或氨基酸序列可能会影响蛋白的合成量,通过优化因果序列可以改善蛋白合成量。
Q2: 使用PUREfrex® 的蛋白合成量是多少?
这个取决于合成的蛋白。例如,试剂盒附带的对照模板DNA二氢叶酸还原酶 (DHFR)使用PUREfrex® 1.0和PUREfrex® 2.0时,每毫升反应液分别可合成约 150 µg和 600 µg。
Q3:是否可以合成和纯化标签蛋白?
PUREfrex® 中的所有蛋白均不含纯化和检测用的标签。因此,可以使用所有标签序列,如组氨酸标签(His tag)。 His tag标签蛋白的纯化方法请点击此处查看。
Q4:是否可以同时合成多种蛋白?
使用不同蛋白编码的多个模板DNA,可在单试管中同时合成多种蛋白。
实验结果显示,根据模板DNA合成的蛋白量有差异时,可以通过调整模板 DNA 的添加量比例来调整蛋白合成量。
IgG 的轻链 (LC) 和重链 (HC)同时合成的结果请点击此处查看。
Q5:PUREfrex® 可合成的蛋白分子量是多少?
多个残基的肽可以合成分子量约为 100 kDa 的蛋白;β-半乳糖苷酶的合成示例请点击此处查看。
Q6:PUREfrex®是否含有分子伴侣?
PUREfrex®是一种仅包含转录和翻译所需因子的蛋白合成系统,因此不含分子伴侣。Gene Frontier推出了一系列可添加至 PUREfrex® 中使用的分子伴侣,如 Hsp70(DnaK Mix:#PF003-0.5)和 Hsp60(GroE Mix:#PF004-0.5)。
Q7:是否能够合成具有二硫键的蛋白(如抗体)?
可以合成。当蛋白需要二硫键才具有活性时,请向 PUREfrex®中加入添加剂 DsbC Set (#PF005-0.5) 或 PDI Set (#PF006-0.5)使用。建议使用已优化合成条件的 PUREfrex® 2.1 (#PF213-0.25) 。抗体 (IgG, Fab, scFv)的合成示例请点击此处查看。
Q8:是否可以合成膜蛋白?
可以合成。但是,大部分情况下合成的膜蛋白会形成聚集。通过将脂质体和纳米盘等脂质成分添加至PUREfrex®反应液合成膜蛋白,或可合成含脂质成分的膜蛋白。
点击此处查看使用纳米盘的合成示例。
Q9:是否可进行糖基化和N端修饰等翻译后修饰?
PUREfrex® 是一种仅重组转录和翻译所需因子的蛋白合成系统,因此,无法单独进行糖基化和N端修饰等翻译后修饰。但是,可以通过向反应液添加翻译后修饰酶及其底物来进行翻译后修饰。
关于糖基化的信息,请点击此处查看。
关于N端乙酰化和肉豆蔻酰化的信息,点击此处查看。
Q10:是否可合成[35S] 蛋氨酸或 [3H] 亮氨酸等放射性同位素标记的蛋白?
通过添加含有[35S] 蛋氨酸或 [3H] 亮氨酸等放射性同位素的氨基酸至合成反应液进行合成,可以合成放射性同位素标记的蛋白。另外,PUREfrex® 1.0含有20种天然氨基酸,其最终浓度均已调至0.5 mM。
Q11:分泌蛋白的合成需要信号序列吗?
使用 PUREfrex® 合成时,不需要信号肽,但翻译是从不会变成N端的序列开始的,这可能会导致合成量降低。因此,建议优化除信号序列以外的序列(尤其是N端)。详情可查看模板DNA问题1。
Q12:PUREfrex® 的密码子出现频率与大肠杆菌相同吗?
PUREfrex® 使用从大肠杆菌中制备的tRNA混合物,各tRNA的浓度均反映了大肠杆菌中tRNA浓度。因此,大肠杆菌内含量较低的tRNA在PUREfrex® 反应液中的含量也较低。
综上,PUREfrex® 合成蛋白的模板DNA建议使用与大肠杆菌使用频率相匹配的密码子。此外,设计模板DNA时的注意事项请点击此处查看。
Q13:PUREfrex® 中表达的蛋白/肽的N端蛋氨酸是否甲酰化?如果是甲酰化,翻译过程中和翻译后是否会脱甲酰化?
使用 PUREfrex® 合成的蛋白的N端蛋氨酸被甲酰化,并且在翻译过程中和翻译后也不会去甲酰化。
但是,根据合成的蛋白量的不同,甲酰基供体耗尽,合成的蛋白中可能会混有部分没有甲酰化的蛋白。即使N端蛋氨酸未被甲酰化,PUREfrex® 也能继续进行翻译反应,但根据合成的蛋白不同,可能会影响合成效率。
◆关于模板DNA
Q1:模板DNA的制备和优化的要点是什么?
关于模板DNA的制备和优化的要点请查看以下页面。
关于模板DNA
模板DNA序列相关的6点注意事项
Q2:靶蛋白基因的上游需要什么序列?
模板DNA在编码靶蛋白的基因上游至少需要T7启动子序列和核糖体结合位点(SD 序列)。
Q3:可以使用T7启动子以外的启动子吗?
PUREfrex® 的反应液中含有作为转录酶的T7 RNA聚合酶,所以推荐使用含T7启动子的模板DNA。使用其他启动子时,需添加该启动子对应的RNA聚合酶进行反应。
Q4: 5’UTR的序列可以改变吗?
可以改变。但是,5’UTR序列会影响蛋白合成量,5’UTR序列对合成回收量的影响点击此处查看。目前,GeneFrontier设计的5' UTR 序列的蛋白合成量较高。序列中各区域对合成量的影响各异,因此,请根据实验目的进行调整。
Q5:可以使用哪些终止密码子?
PUREfrex® 中所含的两种翻译终止因子(解离因子),与三种终止密码子(UAG(amber)、UGA(opal)、及UAA(ochre))相兼容,因此可以使用任意一种终止密码子。
Q6:靶蛋白基因的下游需要什么序列?
使用环状DNA时,编码靶蛋白的基因下游需要终止转录的T7 终止序列。使用直链DNA时,请在终止密码子的下游添加10个以上的碱基。此外,对于直链DNA,终止密码子下游不一定需要T7终止序列。
Q7:当使用两步PCR制备PUREfrex® 用的模板DNA时,对于”REV primer”是否存在“10个碱基以上的任意序列”的限制要求呢?
“REV primer”基本上是可任意选择的,但是需要注意以下几点。
● ORF部分的C端之后的"taatga "部分是2个终止密码子并列的序列。
● 比起序列,长度更重要。长度小于10个碱基会影响合成效率;长度大于10个碱基,即使是20个碱基也没问题。
● 应尽可能避免在终止密码子后放入可形成刚性二级结构的序列(如高GC含量)。
● 例如,该部分可插入限制性酶切位点。
Q8:反应溶液中应该加入多少模板DNA?
无论是质粒还是 PCR 产物,DNA的添加量均为每 kbp 0.5-3 ng/µL。
添加至PUREfrex® 反应液中的DNA以分子数(摩尔浓度)为基准,添加后的最终浓度应在2 nM 左右。例如,添加至反应液中的DNA是长度为6 kbp的质粒(环状DNA)时,则无论实际 ORF 长度如何,添加量应均为(0.5~3)×6 = 3~18 ng/µL。
Q9:模板DNA能否溶解于TE缓冲液中使用?
TE 缓冲液中所含的EDTA可能会抑制转录和翻译反应,减少蛋白合成量。溶解DNA时,建议使用不含EDTA的缓冲液或Milli-Q水。
Q10:直接添加PCR反应液时应注意什么?
为了减少从PCR反应液中引入盐等物质,添加量请不要超过PUREfrex® 反应液量的 1/10。PCR 反应液中引入的污染会改变盐浓度降低转录和翻译反应的活性。
PCR产物浓度较低时,应避免增加未纯化PCR反应液的添加量,可考虑使用DNA纯化试剂盒等制备足够浓度的DNA溶液。
【参考】使用PCR产物作为模板DNA使用时
Q11:PCR产物所需的纯度是多少?
如果在PCR后的电泳中发现目标产物以外的条带时,请探讨PCR条件以抑制副产物的产生。由于副产物也可能会合成蛋白,所以通过PCR获得的条带纯度会影响蛋白的合成效率。当改变PCR条件仍产生副产物时,需将目标条带从凝胶中切下并纯化。从凝胶切下条带时,为避免DNA损伤(可能会影响转录反应),请不要使用紫外线照射。可以使用蓝光,但应尽量缩减照射时间。
【参考】使用PCR产物作为模板DNA使用时
Q12:是否能使用人工合成的DNA作为模板?
含启动子序列的人工合成片段可以作为模板DNA使用。此外,也可以从仅合成ORF的DNA中,使用含有启动子序列等所需序列的引物,通过PCR来制备模板DNA。但是,根据基因合成生产商的不同,可能会在交付的产品中添加抑制蛋白合成反应RNase。当无法合成目标蛋白时,可尝试添加RNase抑制剂或尝试使RNase灭活。
此外,对于以质粒形式作为模板DNA,请点击此处查看使用质粒作为模板DNA使用时的注意事项。
Q13:哪些质粒载体可用作模板DNA?
可使用含有T7 promoter、SD 序列和 T7 terminator的载体。例如,pET型(Merck公司)、pQE型(Qiagen 公司)等。但是,存在lac operator序列时,可能会减少蛋白合成量,因此推荐使用不含lac operator序列的载体,如pET17等。
Q14:制备模板质粒时应该注意什么?
制备质粒DNA 时,注意不要让纯化时添加至使用缓冲液的RNase活性残留在最终纯化物中。
例如,在使用膜型纯化试剂盒(如 Qiagen的QIAprep Spin Miniprep Kit或Promega 的Wizard Plus SV Minipreps DNA Purification System)时,Lysis buffer中所含的RNase A会混入最终纯化的DNA溶液中。如果直接作为模板DNA添加至PUREfrex® 反应溶液中,转录产物等的RNA会被分解,抑制蛋白合成。
当使用这种纯化试剂盒纯化的DNA溶液,可通过Phenol/Chloroform处理使RNase灭活,再通过乙醇沉淀等再次纯化,即可制备不含RNase活性的DNA溶液。或者,可在 PUREfrex® 反应液中添加RNase inhibitor来合成蛋白。另一方面, Qiagen的 Plasmid Mini Kit 在洗脱与树脂结合的DNA后,向洗脱液添加isopropanol使DNA沉淀,可抑制RNase 活性污染。已确认通过该试剂盒纯化的质粒可直接使用。
【参考】使用质粒作为模板DNA的注意事项
Q15:如何使用RNA作为模板?
使用mRNA合成蛋白时,请使用起始密码子上游中包含SD序列的mRNA。另外,mRNA的添加浓度大约为0.1~1 µM。由于适用浓度因所用mRNA的序列和纯度而异,建议参考上述浓度范围,探讨添加浓度的决定条件。