MassivEV™ EV纯化分离柱 PS/MassivEV™ EV纯化缓冲液套装
用于大规模纯化外泌体等细胞外囊泡的分离柱
以外泌体为代表的细胞外囊泡(EV: Extracellular Vesicles)是由细胞释放的脂质双分子层微囊泡,内含核酸、蛋白和脂质等。作为生物体内细胞间的通信媒介,外泌体相关的研究成为免疫、癌症、神经和代谢等多个领域的研究热点。
EV的应用领域广泛,有望应用于治疗药物、生物标志物和药物递送系统 (DDS)。尤其是间充质干细胞(MSC: Mesenchymal stem cell)分泌的EV具有抗炎、抗纤维化和组织修复等作用1),除医疗领域外,在化妆品和食品等领域也备受关注。
EV的实际应用需要能够高效且大规模分离和纯化高纯度EV的技术。富士胶片和光采用与金泽大学医学系免疫学的华山教授共同开发的分离和纯化技术“PS亲和法”2),开发了用于大规模纯化EV的MassivEV™ EV Purification Column PS(MassivEV™ 细胞外囊泡(EV)纯化分离柱 PS)。配合使用专用的缓冲液MassivEV™ Purification Buffer Set(MassivEV™ 细胞外囊泡(EV)纯化缓冲液套装),可从支持规模放大的细胞培养上清中简易分离和纯化EV。
|
|
|
|
MassivEV™ EV Purification Column PS |
MassivEV™ Purification Buffer Set |
◆产品概要
MassivEV™ EV Purification Column PS和MassivEV™ Purification Buffer Set是用于从大规格细胞培养上清中分离和纯化外泌体等细胞外囊泡(EV)的分离柱和专用缓冲液。采用与EV膜表面的磷酯酰丝氨酸(PS)钙离子依赖性结合Tim4的“PS亲和法”*,可简易纯化高纯度EV。
*利用与EV膜成分的磷酯酰丝氨酸(PS)特异性结合Tim4((T-cell immunoglobulin domain and mucin domain-containing protein 4))的纯化方法。即利用与PS钙离子依赖性结合Tim4的性质,在钙离子存在下,固定在载体上的Tim4可捕获样品中的EV。通过清洗去除杂质后,加入EV Elution Buffer(螯合剂),低损伤状态下从载体上的Tim4的洗脱和纯化EV的方法。
◆特点
● 可从大规格(10 mL至公升级别规格)细胞培养上清中高效分离和纯化高纯度EV
● 无需切向流过滤(TFF)系统等昂贵设备 ※只需一个蠕动泵
表1 从200 mL间充质干细胞培养上清中分离和纯化EV的对比(富士胶片和光评估)
|
MassivEV™ |
TFF+ AEX※ |
TFF+SEC※ |
|
|
可纯化的EV |
PS阳性EV |
取决于样品 |
取决于样品 |
|
纯度 |
高 |
低 |
低 |
|
纯化步骤数 |
1 个步骤 – PS 亲和法 |
2 个步骤 – TFF 系统 – 阴离子交换色谱法 |
2 个步骤 – TFF 系统 – 尺寸排阻色谱法 |
|
EV粒子产量(参考值) |
1.7×1011 particles |
1.1×1011 particles |
0.7×1011 particles |
|
纯化所需时间 |
8 h |
10 h |
10 h |
※AEX: 阴离子交换色谱法; SEC:尺寸排阻色谱法
<参考> 一只小鼠的EV建议给药量3-5):1.0×109 particles/mouse
◆适应性
细胞培养上清(MSC等):10 mL至公升级别规格
※ 从10 mL以下的细胞培养上清中分离EV时,请使用MagCapture™ Exosome Isolation Kit PS Ver.2(产品编号:290-84103)
◆处理样品量
|
1 mL (产品编号:131-19491) |
5 mL (产品编号:137-19493) |
|
|
样品量※1 |
200 mL |
1 L |
|
动态结合能力※2 |
5×1011 particles/mL 树脂 |
2.5×1012 particles/5 mL树脂 |
※1 MSC细胞培养上清中一次纯化可处理的大概样品量。样品处理量因细胞培养上清中所含的EV粒子数而异。处理同一样品时,可重复使用分离柱,已确认最多可使用五次(初次使用1次、重复使用4次)。
※2 使用MSC来源EV的研究结果。可能因细胞种类等条件而异。
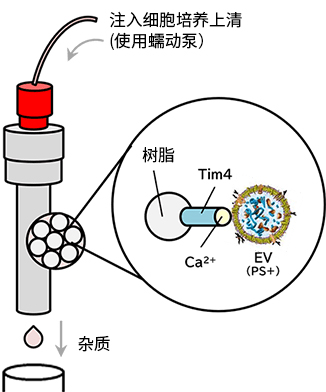
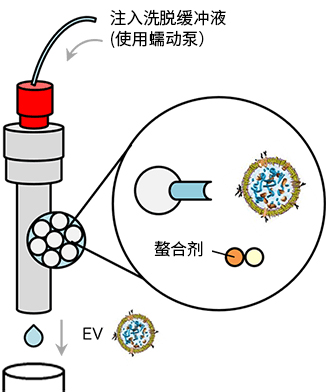
◆原理
PS亲和法利用与EV膜表面的磷酯酰丝氨酸(PS)特异性结合的Tim4,是富士胶片和光开发的EV分离方法。
PS-Tim4结合的高特异性配合螯合剂的温和洗脱,可使EV在完整状态下高纯度分离。
|
结合
|
洗脱
|
|
图1 MassivEV™ EV Purification Column PS(PS亲和法)分离和纯化细胞外囊泡的原理 |
|
◆实验方案

点击此处查看产品使用说明书
◆数据
性能数据
与传统方法对比
在增殖培养基(MSCulture™/ 10% FBS)及EV生产培养基(EV-Up™)中培养骨髓来源的MSC,回收细胞培养上清后,使用0.22 μm过滤器过滤。取200 mL经过滤处理的细胞培养上清用作样品,采用以下4种方法进行分离和纯化。纯化后的EV溶液分别使用Nanoparticle Tracking Analysis (NTA)和ELISA进行分析。
<分离方法>
MassivEV™ MassivEV™ EV Purification Column PS / MassivEV™ Purification Buffer Set (本产品, PS亲和法)
TFF 仅切向流过滤(500 kDa)
TFF+AEX 切向流过滤(500 kDa)+阴离子交换色谱法
TFF+SEC 切向流过滤(500 kDa)+尺寸排阻色谱法
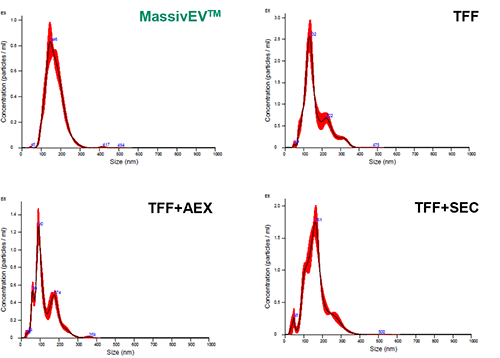
(1)使用NTA 进行粒子分析
|
|
|
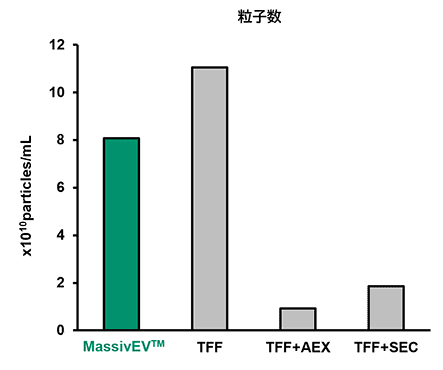
【结果】
与TFF相比,MassivEV™ 纯化得到的粒子数量少,但与 TFF+AEX 或 TFF+SEC 相比,MassivEV™ 纯化得到的粒子数量更多
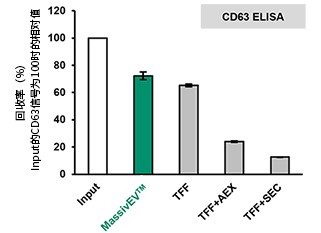
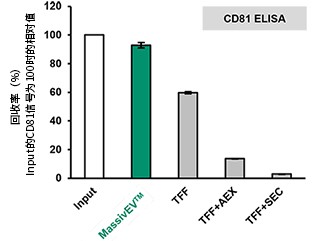
(2)使用CD63 ELISA和CD81 ELISA的EV回收率比较(n=3)
|
|
|
【结果】
相比传统方法,使用MassivEV™ 的EV回收率更高。
点击此处下载外泌体研究产品目录册
点击此处查看更多外泌体系列产品
点击此处查看更多外泌体系列产品技术和应用文章
产品使用说明书

MassivEV™ EV Purification Column
参考文献
1. Phinney, D. G. and Pittenger, M. F.: Stem cells, 35(4), 851(2017).
Concise review: MSC-derived exosomes for cell-free therapy
2. Nakai, W. et al.: Sci. Rep. 6(1), 1(2016).
A novel affinity-based method for the isolation of highly purified extracellular vesicles
3. Mansouri, N. et al.: JCI insight, 4(21), e128060(2019).
Mesenchymal stromal cell exosomes prevent and revert experimental pulmonary fibrosis through modulation of monocyte phenotypes
4. Angioni, R. et al.: Int. J. Mol. Sci., 21(22), 8874(2020).
Administration of human MSC-derived extracellular vesicles for the treatment of primary sclerosing cholangitis: preclinical data in
MDR2 knockout mice
5. Perets, N. et al.: Mol. Autism, 11(1), 65(2020).
Exosomes derived from mesenchymal stem cells improved core symptoms of genetically modified mouse model of autism Shank3B