CYTO-ID® 自噬检测试剂盒 2.0
CYTO-ID® Autophagy Detection Kit 2.0 使用新型染料检测自噬小泡和监控活细胞自噬流,选择性标记积累的自噬小泡。染料已通过优化,不染溶酶体,在自噬前体、自噬体和自噬溶酶体里呈现出明 亮的荧光。该试剂盒提供了一种无需细胞转染,可以在活细胞中监控细胞自噬的快速定量方法。
◆特点
● 更明亮,更耐光,特异性染色自噬小泡
● 无需转染及转染效率验证
● 快速量化原生异质性细胞群中的自噬
● 不染溶酶体,减少其他染料的背景干扰
● 便于高通量筛选自噬激活剂和抑制剂
◆原理
该产品所用探针是阳离子两亲性示踪剂(CAT)染料,以类似诱导磷脂药物的方式迅速进入到细胞中。染料的功能基团能够选择性标记与自噬通路相关的小泡,而不会在溶酶体中聚集。
|
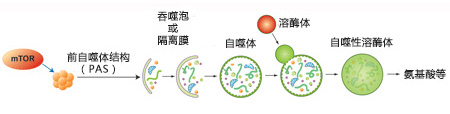
胞内物质被扩大的膜囊包裹,吞噬泡形成双层膜囊泡,成为自噬体。自噬体外膜随后与溶酶体融合,和内部物质被自噬性溶酶体降解。自噬的各种调节因子也被描绘于图中。 |
自噬原理图 |
◆应用
|
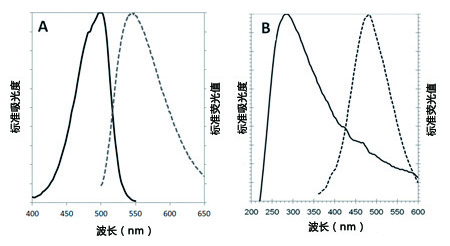
CYTO-ID® 绿色检测试剂2(A组)在PBS确定的吸光度和荧光图谱(499/548 nm)。 Hoechst33342(图B)在1X测定缓冲液来确定的吸光度和荧光图谱(350 /461 nm)。 |
的发放 |
|
|
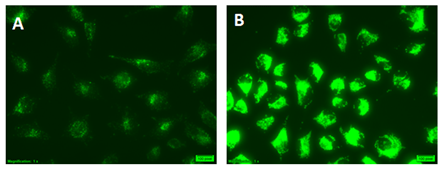
HeLa cells使用 CYTO-ID® Green Detection Reagent 2进行染色
(A) 完全培养基 (B) 在饥饿培养基 (EBSS)中添加40 µM Chloroquine培养4 h 。在含有Chloroquine 的EBSS培养基中培养的细胞表现非常明亮的绿色荧光信号和点状结构。 |
|
|
|
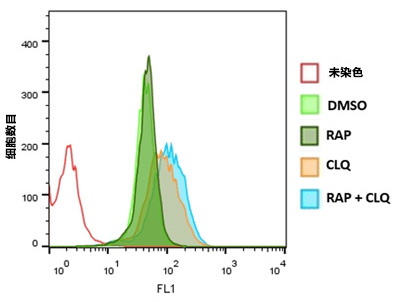
运用流式细胞术分析Jurkat细胞的自噬
通过0.5 µM Rapamycin (RAP), 10 µM Chloroquine (CLQ)处理或不处理Jurkat细胞,或两者一起处理20 h。CYTO-ID® Green Detection Reagent 2染色30 min后,洗脱,用流式细胞仪分析。直方图叠加呈现结果。用RAP+CLQ处理细胞显示荧光有升高。 |
|
|
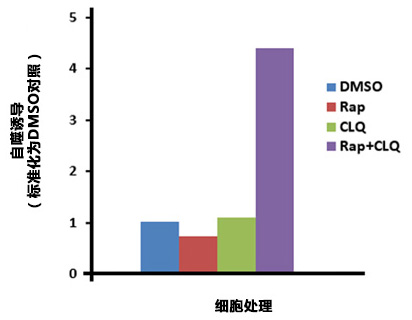
| 微孔板分析HepG2细胞的自噬
HepG2经过DMSO(对照),0.5 μM Rapamycin (Rap), 10 µM Chloroquine (CLQ),或0.5 µM Rap 和10 µM CLQ同时培养20 h。细胞经过Hoechst 33342染色进行细胞数目标准化。Rap 和CLQ同时处理细胞显示自噬作用上升。 |
|
◆相关产品
|
产品编号 |
产品名称 |
规格 |
备注 |
应用 |
| ENZ-51002-25 | GFP-Certified® Apoptosis/Necrosis detection kit
细胞凋亡/坏死检测试剂盒 |
25 assays | 多重检测,区分正常、
早期凋亡、晚期凋亡和坏死细胞,与GFP和其他绿色荧光探针兼容。 |
FC,荧光显微镜,荧光检测 |
| ENZ-51002-100 | 100 assays | |||
| ENZ-51021-K200 | Nuclear-ID® Green
hromatin condensation detection kit 细胞核绿色染色体皱缩检测试剂盒 |
1 Kit | 高渗透性的绿色荧光染色增强了细胞凋亡诱导染色质固缩。 | FC,荧光显微镜,荧光检测 |
| ENZ-52406 | NUCLEAR-ID® Red DNA stain
DNA染色试剂盒(红色荧光) |
200 µL | 细胞可渗透的DNA染色应用广泛。 | ≥93%(HPLC),FC,荧光检测 |
| ENZ-CHM103-0200 | Nuclear-ID® Blue
DNA stain (GFP-Certified®) Nuclear ID® 蓝色DNA染色(GFP细胞系) |
200 µL | 细胞可渗透的DNA染色应用广泛。 | ≥93%(HPLC),FC,荧光检测 |
| ENZ-51015-KP002 | Lyso-ID® Red
cytotoxicity kit (GFP-Certified®) 溶酶体细胞毒理检测试剂盒(红色荧光)(绿色细胞系) |
1 Kit | 快速,定量和HTS-兼容的检测活细胞毒性试剂。 | 荧光显微镜,荧光检测 |
| ENZ-51035-0025 | PROTEOSTAT® Aggresome etection kit 蛋白内稳态® 聚集体 检测试剂盒 |
25 tests | Robust、定量的聚集小体用于神经退行性疾病,肝病和毒理学研究 | FC,荧光显微镜,荧光检测 |
| ENZ-51035-K100 | 100 tests |
相关产品资料请点击下载:活细胞荧光分析 Ver.3
自噬技术文章:
通过流式细胞术定量自噬解释与白血病肿瘤生长的联系
Posted By Morgan Mathieu
Tags: Autophagy, Cancer
主要参考文献
|
(1) |
A live-cell fluorescence microplate assay suitable for monitoring vacuolation arising from drug or toxic agent treatment: J. Coleman, et al.; J. Biomol. Screen. 15, 398 (2010), 摘要; |
|
(2) |
Methods in mammalian autophagy research: N. Mizushima, et al.; Cell 140, 313 (2010),摘要; |
|
(3) |
Assays to Assess Autophagy Induction and Fusion of Autophagic Vacuoles with a Degradative Compartment, Using Monodansylcadaverine (MDC) and DQ-BSA: C.L. Vazquez & M.I. Colombo; Methods Enzymol. 452, 85 (2009),摘要; |
|
(4) |
Desmethylclomipramine induces the accumulation of autophagy markers by blocking autophagic flux: M. Rossi, et al.; J. Cell Sci. 122, 3330 (2009), 摘要; |
|
(5) |
Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes: D.J. Klionsky, et al.; Autophagy 4, 151 (2008), 摘要; |