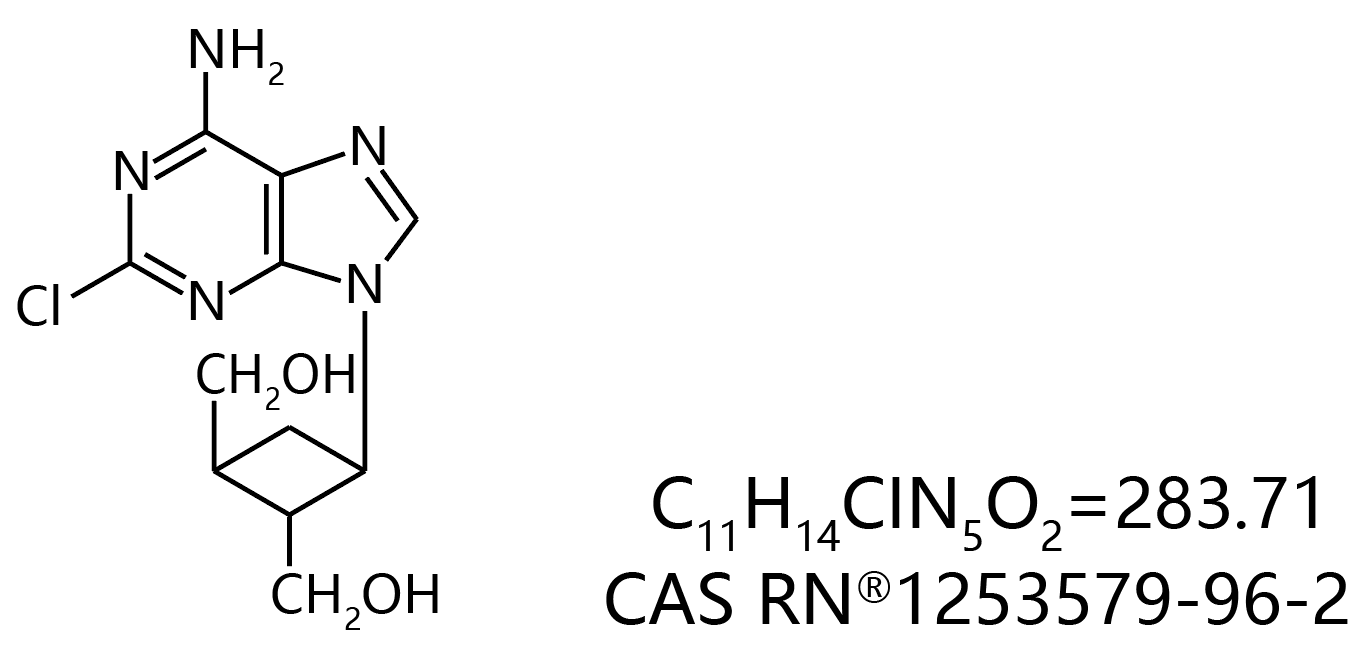
COA-Cl【2-Cl-C.OXT-A】![]()
类VEGF/NGF活性小分子化合物
COA-Cl(2-Cl-C.OXT-A)是具有促进血管生成作用的小分子化合物。此外,它还具有神经保护和营养作用。COA-Cl为水溶性,有望代替VEGF和NGF在再生医疗中用于促进血管和神经的生成。另外,它还可作为Xeno-free培养基的添加剂进行使用。
参与血管生成相关的因子包括VEGF(血管内皮细胞生长因子)、PDGF(血小板衍生生长因子)、HGF(肝细胞生长因子)、FGF(纤维细胞生长因子)和血管生成素等,但这些因子都是大分子肽,并且暂未具类似效果的稳定的小分子肽。
由于血管生成是癌症生成和转移所必不可少的,所以作为抗癌剂的血管生成抑制剂的研发备受关注。此外,针对糖尿病和动脉硬化引起的血管阻塞等导致的血流不足,血管生成促进剂的研发也备受期待。
经验证,COA-Cl在人脐静脉内皮细胞(HUVEC)的培养细胞中具有促进管腔形成的作用。另外,其在鸡绒毛尿囊膜和兔角膜的验证实验中的也证实具有促进血管生成的作用。
◆特点
● 具有促进血管生成作用。
● 可促进HUVEC(人脐带静脉内皮细胞)的血管生成。可促进CAM(鸡胚绒毛尿囊膜)实验中CAM的生成以及兔角膜血管生成。
● 由于不会激活HUVEC细胞中的VEGFR-2、所以可以促进MEK(MAPKK)和ERK1/2(MAPK)的活化(磷酸化)。
◆用途
● 制备血管模型
● 制备疾病模型
● 分析药剂作用机制
● 激活细胞
……
◆应用实例
储备液制备:使用生理盐水溶解至2 mM
使用浓度: 用于HUVEC细胞时,浓度为 10~500 μM
储存条件:室温(溶解后,冷藏保存)
◆产品概况
● 外观:白色~微褐色,结晶性粉末~粉末或结块
● 溶解性:可溶于水
◆数据
■ 在血管内皮细胞和成纤维细胞的共培养体系中使用的案例:促进血管生成作用
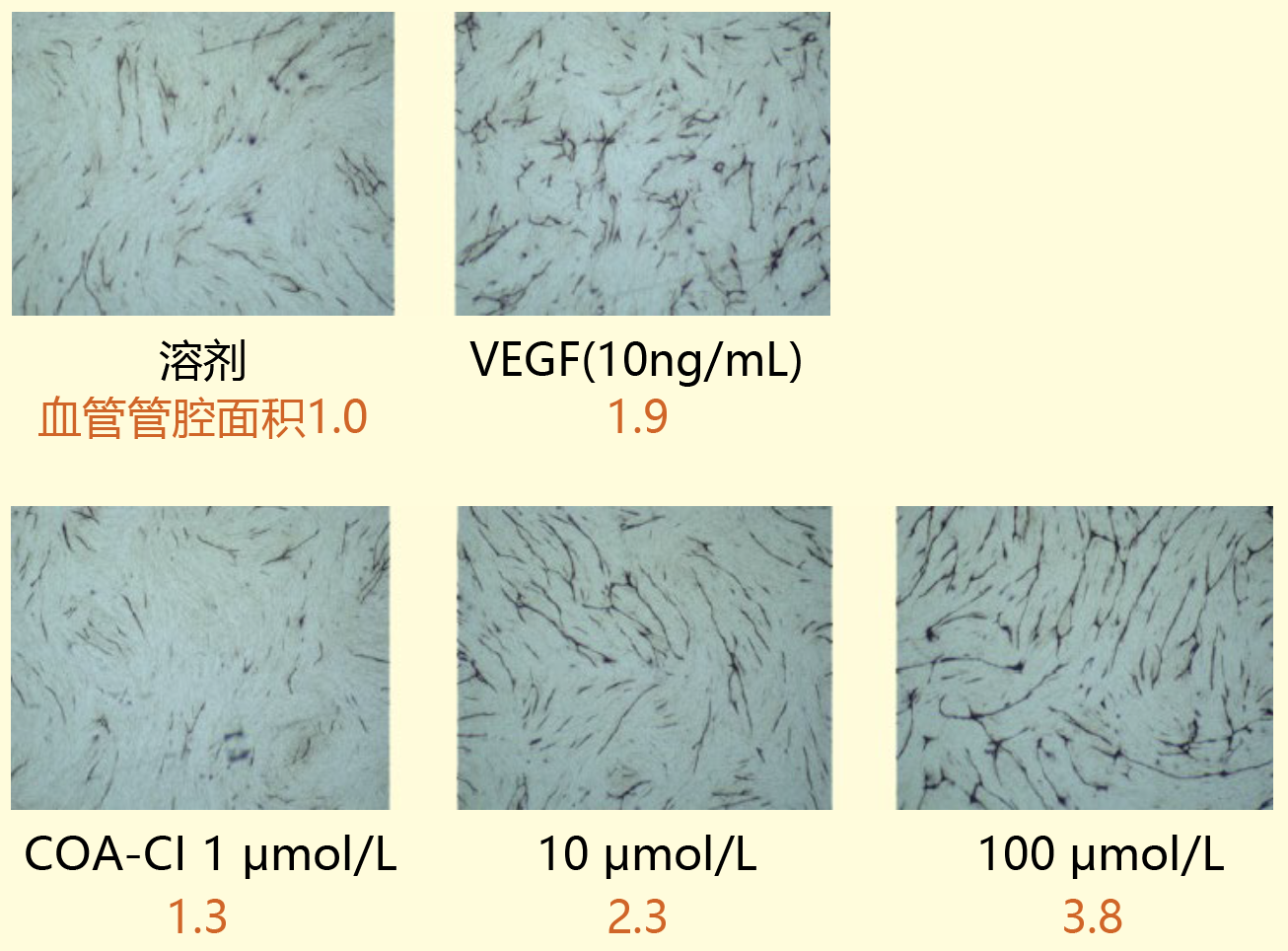
培养10天后形成的血管管腔面积有所增加。
(数据提供:香川大学医学部 塚本郁子老师)
■ 使用鸡绒毛尿囊膜 (CAM)和兔角膜验证促进血管生成作用的案例
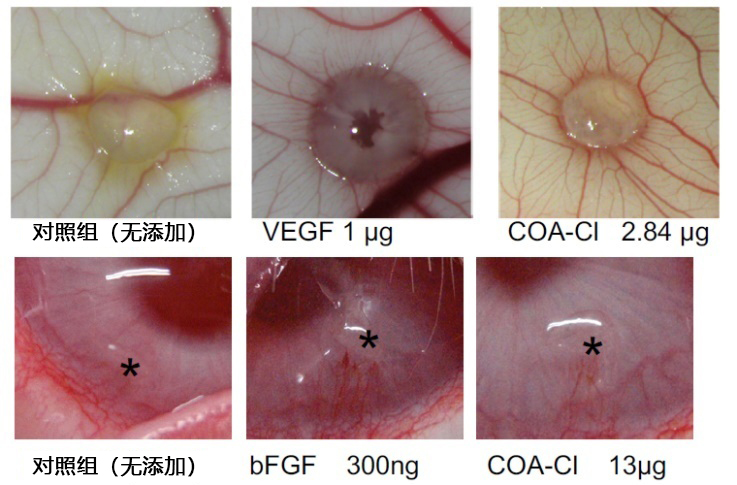
(数据提供:香川大学医学部 塚本郁子老师)
■ 验证在正常人成纤维细胞中促进VEGF产生和分泌的案例
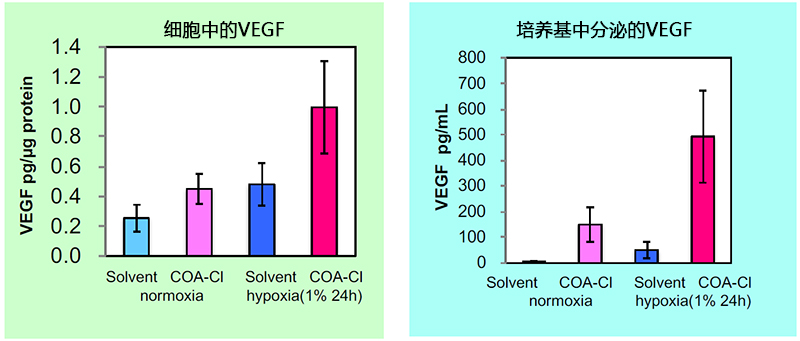
更换为含±COA-Cl(100 mmol/L)的培养基,在常氧和缺氧(1%)下培养24 h后,使用ELISA试剂盒 对中细胞中、培养基中的VEGF进行定量检测。
结果显示,在含有COA-Cl的培养基中培养时,可以观察到VEGF的产生和分泌量更高。
(数据提供:香川大学医学部 塚本郁子老师)
■ 神经模型细胞(PC12)中的突出伸长案列(培养96 h):神经营养作用
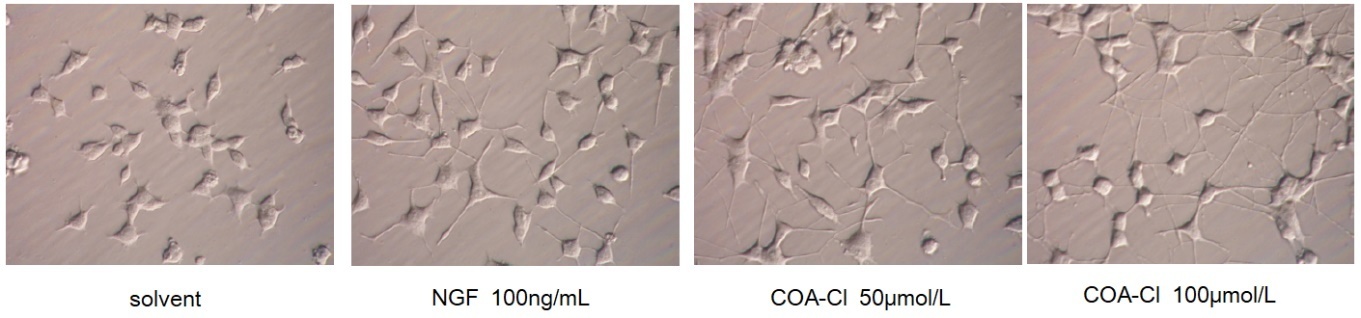
(数据提供:香川大学医学部 塚本郁子老师)
■ 神经模型细胞(PC12)中的多巴胺浓度上升
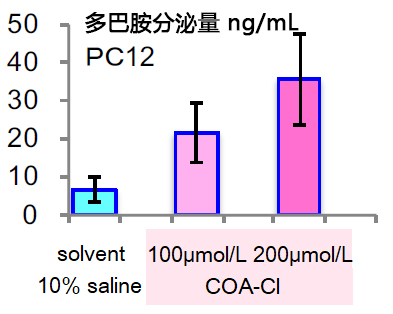
培养3天后,使用HPLC检测培养基中的多巴胺浓度。
结果显示,多巴胺的浓度上升。
(数据提供:香川大学医学部 塚本郁子老师)
■ 大鼠神经胶质瘤细胞(C6)的培养案例:细胞保护作用

(A)D-MEM (B)D-MEM+血清(马15%+牛2.5%)(C)D-MEM+COA-Cl(100 μmol/L)
接种大鼠神经胶质瘤细胞(C6)至24微孔板,第二天分别加入到(A)、(B)、(C)培养基,培养16天(无需更换培养基)第12天时,(A)和(B)中的细胞已死亡,但(C)中没有任何变化,并且在第14天时将培养基更换为(B)后,细胞开始增殖。
(数据提供:香川大学医学部 塚本郁子老师)
■ 神经模型细胞(PC12)的培养案例:作为血清替代物使用的可能性
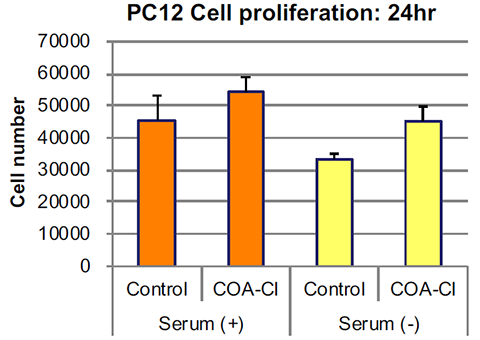
接种神经模型细胞(PC12),次日更换D-MEM±血清(马10%+牛5%),添加COA-Cl(100 μmol/L),24 h后计算细胞数。
结果显示,添加COA-Cl时,细胞数增加。此外,在不含血清的培养基中,添加了COA-Cl的培养基与添加了血清的培养基有着相同程度的细胞增殖。
(数据提供:香川大学医学部 塚本郁子老师)
■ 神经模型细胞(PC12)中的培养案例:对氧化应激的保护作用
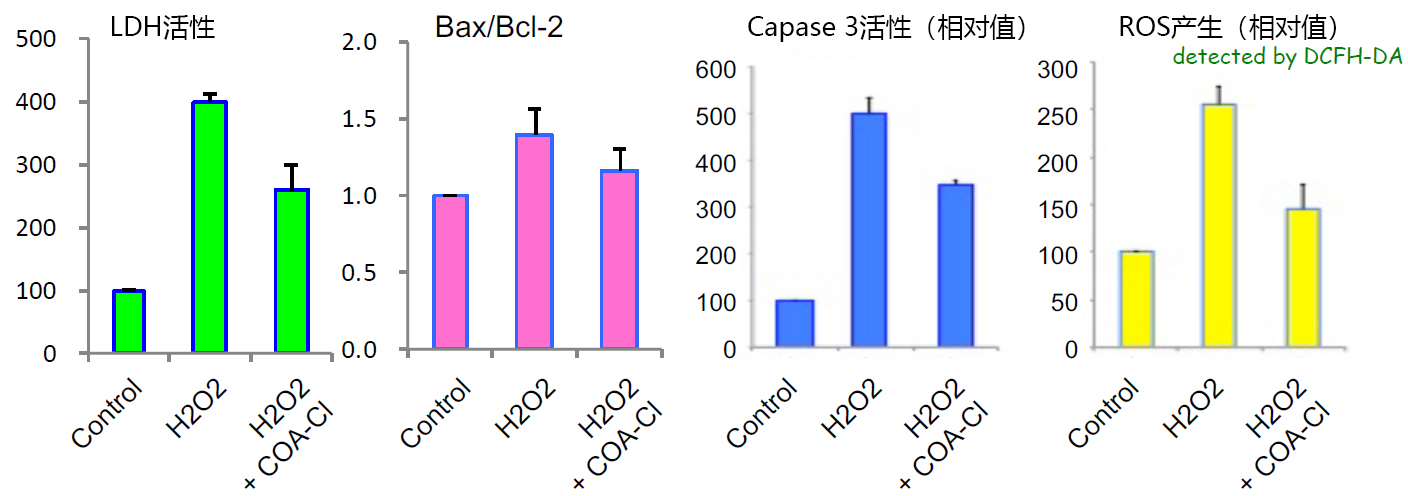
接种神经模型细胞(PC12),次日更换培养基,添加COA-CI(10 μmol/L)和过氧化氢(200 μmol/L)。24 h后检测响应应激释放的LDH、凋亡相关蛋白以及活性氧。
结果显示,添加COA-CI时,LDH、凋亡相关蛋白以及活性氧的释放量有所减少。
(数据提供:香川大学医学部 塚本郁子老师)
※ 本页面产品仅供研究用,研究以外不可使用。
点击此处进一步了解应用案例
参考文献
|
1. |
Tsukamoto, I., Sakakibara, N., Maruyama, T., Igarashi, J., Kosaka, H., Kubota, Y., Tokuda, M., Ashino, H., Hattori, K., Tanaka, S., Kawata, M. and Konishi, R. : Biochem. Biophys. Res. Commun. 399, 699 (2010). COA-Cl 在血管内皮细胞 (HUVEC) 中可激活 VEGF 受体下游 的MAP 激酶级联的 MEK和ERK1/2。 |
|
2. |
Igarashi, J., Hashimoto, T., Kubota, Y., Shoji, K., Maruyama, T., Sakakibara, N., Takuwa, Y., Ujihara, Y., Katanosaka, Y., Mohri, S., Naruse, K., Yamashita, T., Okamoto, R., Hirano, K., Kosaka, H., Takata, M., Konishi, R. and Tsukamoto, I. : Pharmacol. Res. Perspect., 2(5), e00068 (2014). S1P1 受体和钙离子参与相关过程。 |
|
3. |
Igarashi, J., Okamoto, R., Yamashita, T., Hashimoto, T., Karita, S., Nakai, K., Kubota, Y., Takata, M., Yamaguchi, F., Tokuda, M., Sakakibara, N., Tsukamoto, I., Konishi, R. and Hirano, K. : Physiol. Rep., 4, e12742 (2016). 证实VEGF基因水平(mRNA)上升。转录辅因子 PGC1α而非HIF1α 发挥作用。 |
|
4. |
Okabe, N., Nakamura, E., Himi, N., Narita, K., Tsukamoto, I., Maruyama, T., Sakakibara, N., Nakamura, T., Itano, T. and Miyamoto, O. : Brain Res., 1506, 115 (2013). 在大鼠脑梗塞模型中,COA-Cl使受损体积减少,改善了临床评分。 |
|
5. |
Kishimoto, Y., Tsukamoto, I., Nishigawa, A., Nishimoto, A., Kirino, Y., Kato, Y., Konishi, R., Maruyama, T. and Sakakibara, N. : Data Brief, 20, 1877 (2018). 改善阿尔茨海默病模型小鼠的记忆学习行为。 |
|
6. |
Jamal, M., Tsukamoto, I., Takata, M., Ito, A., Tanaka, N., Miki, T., Takakura, A., Ameno, K., Kubota, Y., Konishi, R. and Kinoshita, H. : Brain Res., 1706, 68 (2019). 神经模型细胞(PC12)和小鼠大脑中的多巴胺浓度上升。 |
|
7. |
Lu, F., Nakamura, T., Okabe, N., Himi, N., Nakamura-Maruyama, E., Shiromoto, T., Narita, K., Tsukamoto, I., Xi, G., Keep, R. F. and Miyamoto, O. : J. Stroke Cerebrovasc. Dis., 25, 2637 (2016). 大鼠脑出血模型症状得到改善。 |
|
8. |
Nishikido, T., Oyama, J., Shiraki, A., Tsukamoto, I., Igarashi, J. and Node, K. : Sci. Rep., 9, 2533 (2019). 小鼠心肌梗死模型症状得到改善。 |
|
9. |
Kawami, M., Deguchi, J., Yumoto, R., Sakakibara, N., Tsukamoto, I., Konishi, R. and Takano, M. : Drug Metab. Pharmacokinet., 32, 224 (2017). TGFβ 诱导的肺纤维化得到抑制。 |
|
10. |
Nakai, K., Karita, S., Igarashi, J., Tsukamoto, I., Hirano, K. and Kubota, Y. : J. Dermatol. Sci., 94, 205 (2019). TGFβ 诱导的皮肤纤维化得到抑制。 |
